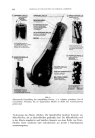
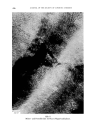
MORPHOLOGISCHER AUFBAU DES MENSCHLICHEN HAARES 703 Abb. 16: Mikrofibrillen in weig- blondiertem Durch Nachkontrastierung mit Bleisalzen lassen sich die Mikrofibrillen in Protofibrillen aufl Ssen (Abb. 7). Ftihrt man die Vorbehandlung reit 5 % Thio- glykolsiiure bei pH 5,5 48 Stunden bei 50 ø C durch, so werden, wie die Abb. 17 zeigt, siimtliche Mikrofibrillen zerst Srt. Die Struktur der Zellwkinde ist aber Abb. 17: 48 h bei 50 ø C reit 5% Thio- glykols•iure bei pH 5,5 behandeltes Haar. besonders gut zu erkennen. Augerdem findet man eine groge Zahl yon dunklen Agglomeraten, bei denen es sich wahrscheinlich um Kristallite yon Osmium- Schwefelverbindungen handelt. Wit glauben, dag die elektronen-mikrosko- pische •hnlichkeit yon Wolle und Haar immerhin so grog ist, um die Ergeb-
704 JOURNAL OF THE SOCIETY OF COSMETIC CHEMISTS nisse von Lundgren zur weiteren Deutung unserer elektronen-mikroskopi- schen Aufnahmen heranziehen zu k/Snnen, zumal Fraser und Lennox (13) zu iihnlichen Ergebnissen kamen. Die 't-Kerato,se enthiilt sehr viel Cystin. Sie ist also sehr schwefelreich. Gleid•- zeitig besitzt sie die dreifache Menge Prolin wie die u-Keratose. Wir nehmen an, dag die 't-Keratose beim Abbau der Matrix entsteht, da diese einen gr/Sge- ren Schwefelgehalt besitzt als die Mikrofibrillen. Der hohe Antell an Prolin verhindert die Kristallisation, da dem Prolin die Fiihigkeit fehlt, Wasserstoff- briicken zu bilden, die den Zusammenhalt der Peptidspiralen herbeifiihren. Die a-Kerato•se neigt zur Kristallisation. Sie ist h/Sher molekular als die ,•-Kera- tose und enthiilt verhiilmismiigig wenig Schwefel. Sie entsteht unseres Erach- tens at•s der Mikrofibrillen-Substanz. Aus der Tabelle II geht hervor, dag die a-Keratose von solchen Aminosiiuren, die einen grogen Molekiilrest, wie Tyrosin, Phenylalanin, Leucin und Ly,sin besitzen, mehr enthiilt als die 't-Kera- tose. Durch die grof•en Aminosiiurereste ist die u-Keratose nicht in der Lage, wie die Seide in Schichten zu kristalliseren. Vielmehr zwingen die voluminiSsen Reste die Peptidkette offensichtlich zu einer Kristallisation in Spiralen, die durch das Einrasten der Wasserstoffbriicken ihre endgiiltige Stabilitiit ge- winnen. Die Zellwiinde der Spindelzellen sind besonders widerstandsfiihig gegen &emi- sche Einfliisse. Sie diirften eine gewi,sse Verwandtschaft mit der fi-Keratose besitzen, die Alexander und Earland (14) bei der von ihnen untersuchten Wolle, die sie mit Peressigsiiure behandelten, als unliSslichen ROckstand fanden. Vor allem die i/ugere Schuppenschicht ist unliSslich zuriickgeblieben. Die Autoren nehmen an, daf• im 13-Keratin starke Wasserstoffbriickenbindungen, •ihnlich wie bei der Seide, vorliegen, dag das fi-Keratin gleichzeitig aber noda cystin- reich sei. Bei der elektronen-mikroskopischen Aufnahme der Schuppen zeigt sich ein starker Kontrast, der ein erhiShtes Vorliegen von Schwefel anzeigt (2). Bei allen von uns angewandten Priiparationstechniken konnten wir bi,sher bei den Schuppen keine Mikrofibrillen entdecken, so dag wir annehmen miissen, daf• dort eine andere Keratin-Struktur vorliegt. Bei der iiblichen Priiparation mit Thioglykolsiiure werden freie SH-Gruppen im Haar erzeugt, mit denen sich das Osmiumtetroxyd verbindet. Man kann also unterstellen, dag abgesehen von den PigmentkiSrnern, bei denen besondere Verhiiltnis,se vorliegen, die dunklen Stellen in den mikroskopischen Aufnahmen ein verstiirktes Auftreten yon freien SLI-Gruppen, beziehungsweise einen erh6hten Schwefelgehalt, anzeigen. Die Matrix mug demnach schwefelreich, die Mikrofibrillen miissen schwefel•irmer sein. Wenn man Wolle und Haar durch chemische Abbauvorgiinge in verschiedene Fraktionen zerlegen will, so wird zweckmiigigerweise zuniichst die Schwefel- briicke oxydativ oder unter Umstiinden auch reduktiv gespalten. So behandelte
Purchased for the exclusive use of nofirst nolast (unknown) From: SCC Media Library & Resource Center (library.scconline.org)