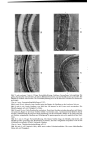
Bild 7) nach weiteren 3 rain in 3%iger Forrnaldehydl/3sung. Sichtbare Entquellung, Schrumpfung. Die gelben Randstreifen sind schmiiler, die blauen Mittelstreifen breiter und die Medulla diinner geworden. Die Medulla ist vielfach unterbrochen. Die Formaldehydl/3sung ist bis in die innersten Schichten des Haares ein- gedmngen. ttaar in t norm. Ammoniumthioglykolatl6sung, pI-t 9,2: Bild 8) nach 20 sek. Schmaler toter Streifen zeigt den Beginn der Quellung an der konkaven Seite an. Bild 9) nach 6 min. Starke Quellung yore Rand her. Im Inneren ist der Cortex noch unveri•ndert. Die Medulla beginnt sich reit Fliissigkeit zu fiillen. Bild 10) nach 10 min. Gelbe Randstreifen verbreitert. Rotviolette Streifen zwischen den gelben und blauen. Im konkaven Bogen ist der blaue Streifen vielfach yon breiten roten, verschwommenen Bi•ndern durch- brochen (Auflockerung der Struktur dutch Stauchung). An der Knickstelle (Pfeile) ist die Farbe sehr hell, ein Zeichen weitgehender Quellung und Schiidigung. Im ganzen gesehen eine sehr ungleichmiitgige Quel- lung. Bild 11) 3 rain in 3%iger Formaldehydl/Ssung. Die blauen Streifen Fringe der Medulla sind breiter, die Medulla dunklet geworden. Der Durchmesser ist kleiner, das Haar weitgehend entquollen. Farbe an der Knickstelle unver'findert (Pfeile), bleibender Schaden. Haar in I norm. Thioglykol as u' ehydrar •idl•sung, p H 6,2: Bild 12) nach 3 min. Stiirkeres Haar, daher etwas andere Polarisationsfarben. Die ersten Medullazellen fiillen sich reit Fliissigkeit.
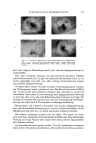
QUELLUNG DES HAARES IN KALTWELLMITTELN 553 Im Innern des Cortex erscheinen wieder h6here Polarisationsfarben (Abb. 7, 11 u. 14). Aber auch hier wird die ursprtingliche Polarisationsfarbe erst nach dem Trocknen des Haares wieder erhalten. Die Untersuchungen haben gezeigt, dab Beobachtungen im Polarisations- mikroskop ein gutes Bild von dem Eindringen der Kaltwellfitissigkeiten und yon Fltissigkeiten tiberhaupt in den Cortex geben. Das Eindringen ist weit- gehend abh•ingig yon dem Zustand des Haares. Porosit•it und mechanische Sch•iden f6rdern die Quellung sehr. Der pH-Wert hat ausschlaggebende Be- deutung. In Mercapto16sungen mir pH-Werten unter 9,5 - die Grenze ist nicht scharoe- verl•iuoet der Quellvorgang ungleichm•iBig und weniger rasch. Einstellungen tiber pH 9,5 lassen das Haar schnell und gleichm•iBig quellen und sch•idigen stark. Unterschiedliche Schichtungen, die auf ein Nebeneinander von Ortho- und Paracortex hinweisen, wurden am glatten Haar bei den Untersuchungen nicht gefunden (22, 23, 24, 25). Das ungleichm•iBige Eindringen der Fltissigkeiten, kenntlich an der differierenden Farb•inderung, wird auf Lockerstellen und Fehlstellen zurtickgeftihrt, l•iBt aber die Frage berechtigt erscheinen, ob nicht, wie bei gewissen Wollfasern, ein Durchwachsen beider Strukturen, Ortho- und Paracortex, vorliegt. Untersuchungen am eng gekr•iuselten Negerhaar wtirden hier weitere Auskunft geben. Bild 13) nach 20 min. Zwischen gelben Randstreifen und blauen Streifen im Inneren breite orange-rote nach rotviolett verlaufende Streifen. Im konkaven Bogen breiter und etwas ungleichm•if•i•. Medulla voll- kommen mit Fltissigkeit gertlilt. Gleichm•iBige Quellung im Gegensatz zu Bild 10. Bild 14) nach 3 min in 3 % iger Hydroperoxyd16sung und anschlief•endem Einlegen in 3 % ige Formaldehyd- 16sung. Die Quellung ist fast vollkommen zurtickgegangen. Farben wie Bild 12. ]-Iaar in 10%igem -/tmmoniamthioglyko]at, pH eingestellt mit konzentriertem Ammoniak auf 9,7, Zusatz yon NetzmitteL Bild 15) nach 30 sek. Beginn der Quellung besonders im konkaven Bogen. Bild 16) nach 5 min. Sehr starke Quellung vom Rand her. Helle, scharfe abgesetzte Randstreifen. Medulla undeudich rotviolett. Die Quellung gleichm•iflig stark yon auflen nach innen. Einige Einbruchstellcn (Pfeile). Bild 17) nach 8 min. Schr starke Quellung, nut wenige Stellen des Cortex sind noch nicht erfafk. Bild 18) nach 3 min in 3 % igem Hydroperoxyd und •/2 norm. Essigs•iure. Im Inneren wieder blaue bis rot- violette Polarisationsfarben. Konvexer Randstreifen dunkelgelb. Durchmesser verringert. Beachtliche Ent- quellung. Der konkave Innenbogen ist hell geblieben hier starke Sch•tdigung des Cortex. Zum Vergleich einige Bilder im normMen Licht mir Phasenkontrast-Optik aufgenommen: ]]aar in kon•.enlrierler •chm6re]sdure : Bild 19). Die Cuticula ist vollsffmdig aufge16st, der Cortex bis auf die innersten Parden in Auf16sung bcgriffen. lm konkaven Bogen ist der Cortex wulstartig gestaucht, der Zellverband st•irker gelockert als im konvexen Bogen. Haar nach ldngerer Fimvirkm•g eines handelsiib/ichen Kalt•'e#mittels: Bild 20). Thioglykols•mrcgehalt 9,9%, pH 9,4. Starke, aber gleichm•dlige Quellung, auch der Medulla. lm konkaven Bogen feine •,7ulstbildung in etwa der Breite der Cuticularinge. bIaar in 30%iger Kaliumhydro.¾ydlb's •ng nach 20 Minaten bei 20 ø C: Bild 21 und 22). Cu'zic2la noch intakt. Im konkaven Bogen starke Wulstbildung. Medulla starke L•ings- quellung im Gegcnsatz zur Breitenquellung in Kaltwellmitteln (Bild 20). Korkzieherartige Windungen (Pfeile). Im engen Bogen Verschiebzn dutch die plastisch-verfltissigte Cortexmasse nach der konvexen Seite. Dort Anreicherung parallel gerichteter Zellfragmente. Cuticula und Medulla sind wie bekannt gegen starke Alkalien widcrstandsf•thiger als der Cortexzellverband. Die Mikrophotographien wurden mir einer Objektivvergr6flerung 20: 1 und einer neunfachen Okular- vergr6Berung g3oeertigt. Die Polarisationsfilter waren um etwa 10 bis 15 ø zur geringen Aufhellung des (½esizhtsfeldes verst:llt. Die Belichtungszeit betrug 3 Sekunden.
Purchased for the exclusive use of nofirst nolast (unknown) From: SCC Media Library & Resource Center (library.scconline.org)