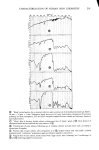
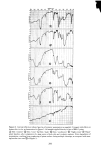
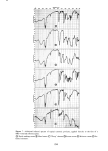
ISOCAMPHANE DERIVATIVES 321 gebracht wird. Die Irrtumswahrscheinlichkeit, dag dieses Ergebnis zu- f•illig ist, betr•igt weit unter 1%. Etwas fiberraschend ist die gute Korrelation von • mit dem Molekulargewicht. Denn a priori ist es nicht vorauszusehen, daf• mit steigendem Molekulargewicht sich nicht auch der Geruchseindruck •indert. Tats•ichlich geben die in Abbildung 3 angeffihrten Ergebnisse der Messungen einen weiteren Beweis daffir, dat• ffir den ,,Grundgeruch" [Prim•irgeruch} haupts•ichlich die Molekfilgestalt und somit die Raumerftillung verantwortlich ist. Eine Erklarung ffir die weite Streuung der als blumig riechenden Verbindungen kann fibrigens darin gefunden werden, daf• unter dem Begriff ,,blumiger Geruch" auch holzige, fruchtige und andere ahnliche Geruchsnoten mit einbezogen werden. Die Vielfalt der unter ,,blumig- fruchtig" einzuordnenden Gerfiche ist ja bekannt. Yamasaki und Mitarbeiter [25} zeigten in einer Studie, daf• die camphrig riechenden Substanzen in einem Diagramm auf einer verhalt- nismagig kleinen Flache, die man mit einer Ellipse umschreiben k6nnte, beisammen liegen, wahrend die blumigen Gertiche, die an die Ver- bindungen mit camphrigen Geruch in der Richtung der geringeren Fltichtigkeit anschliegen, eine weite Streuung aufweisen. Das Gebiet der blumigen Gertiche ist nach diesen Angaben in sich nicht geschlossen, sondern umschliegt auch unter anderem die minzig und faulig-fakalartig riechenden Substanzen. |edenfalls ist -- wie vor allem aus Abbildung 4 ersichtlich ist -- der fiber • = 900 liegende Bereich nicht den camphrigen Gertichen zu- zuordnen. Die Theorie von Arnoore stimmt mit dem Ergebnis der Geruchsprfifung bezfiglich Grundgeruch der untersuchten Isocamphanverbindungen fiber- ein. Dies gilt jedoch nicht ffir Geruchsnuancen, denn es ist unwahrschein- lich, dag kleine 'A•nderungen des Molekfils eine wesentlich andere Raum- erffillung zeigen, womit ein anderer Primargeruch hervorgerufen werden k6nnte. Diese Geruchnuancen werden sicherlich durch Sekundareffekte, die auch im Bereich des Rezeptors liegen, und weiteren molekularen Parametern hervorgerufen. Die in der Einleitung gegebene Problemstellung, derzufolge die l•leine- ren, kugelig geformten Molekfile dem camphrigen Geruchstyp zuzuordnen sind, w•ihrend die reit l•ingerer Seitenkette ausgestatteten Verbindungen einen anderen Geruchseindruck hervorrufen sollten, wurde durch die vorliegende Arbeit voll bestatigt. Es kann also als Resumee die Gesetz- m•igigkeit gezogen werden, dag innerhalb der Isocamphanreihe mit abnehmender Kugelform des Molekfils auch der camphrige Geruchs-
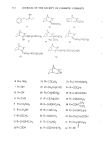
322 JOURNAL OF THE SOCIETY OF COSMETIC CHEMISTS eindruck verblagt. Dies mfigte auch ffir endo-konfigurierte Substanzen am C2-Atom zutreffen. Die Clbereinstimmung der Ergebnisse mit der Amoore'schen Theorie ist bei der Verbindungsklasse der Isocamphane gegeben. Zusammenfassung An Hand von verschiedenen Isocamphanverbindungen wurde gezeigt, inwieweit die stereochemische Theorie von Arnoore zur Erklfirung des Geruchseindruckes angewendet werden kann. Mit Hilfe des Schatten- korrelationstestes wurden die Molekfile gegenfiber der Standardsubstanz 1,8-Cineol vermessen. Die l•bereinstimmung der Ergebnisse mir anderen Molekfilparametern wurde geprfift. Die kugelig geformten Molekfile dieser Reihe rufen emen camphrigen Geruchseindruck hervor und es nimmt dieser reit zunehmender Asymmetrie der Molekfile ab. (3} (4} (71 (91 I101 Illl (12 [13 (14 (15 (16 (17 (18 119 (20 (21 [22 [23 [24 (251 Literatur Amoore, J. E., Molecular Basis of Odor. Charles C. Thomas Publ. Springfield 1970. Klissenbauer, E., Diplomarbeit, Universit& Wien, 1977. Mazziotti, A., Nature 250, 645 [197211. Reckhard, H., Erd61 u. Kohle 11,234 [19581. Cavalli-Sforza, L., Biometrie, Grtmdzfige biolog. med. Statistik, G. Fischer Vlg., Stuttgart 1972. Ther, L., Gnmdlagen der experimentellen Arzneimittelforschung, Wiss. Vlg. Ges. m. b. H., Stuttgart [1965}. Nametkin, S., Ann. Chem. 438, 185 [19241. Ipatiev, W., Bet. dtsch. chem. Ges. 45, 3206 [1912[. Hana, G. W., Dissertation, Universit& Wien, 1971. Beckmann, S. und Geiger, B., Chem. Bet. 94, 1910 [1961}. Buchbauer, G., Synthesen i.d. Isocamphanreihe 5. Mitt., Mh. Chem., im Dmck. Komppa, G., Ann. Chem. 366, 75 (19091. Hana, G. W., Buchbauer, G. und Koch, H., Mh. Chem. 107, 945 11976). Lipp, P., Dessauer, H. und Wolf, E., Ann. Chem. 525, 271 [1936[. Arnoore, J. E. und Venstrom, D., J. Food Sci. 31, 118 [19661. Aschan, O., Ber. dtsch. chem. Ges. 41, 1092 [1908}. Buchbauer, G., Hana, G. W. und Koch, H., Mh. Chem. 107, 387 [1976[. Buchbauer, G., Hana, G. W. und Koch, H., Arch. Pharm., im Dmck. Langlois, G., Ann. Chim. [9], 12, 290 11919}. Lipp, P., K/tippers, P., Holl. M., Bet. dtsch. chem. Ges. 60, 1575 [1927}. Buchbauer, G., Sci. pharm., 45, 196 (1977). Buchbauer, G., Mh. Chem., im Dmck. Buchbauer, G., Dissertation, Universitat Wien, 1971. Buchbauer, G., Tetrahedron Letters 1977, 7. v. Soden, H., Arch. Pharm. 238, 353 11900} Ruzicka, G. und Thomann, G., Helv. Chim. Acta 18, 355 [1935[. Jamasaki, H., Katuhara, J. und Yamamoto, N., Koryo 1970, 33.
Purchased for the exclusive use of nofirst nolast (unknown) From: SCC Media Library & Resource Center (library.scconline.org)